

佟刚,赵守柱*,庄永龙,颜崇超*.一体化信息技术在临床研究中的应用[J].中国食品药品监管.2022.01(216):90-97.
一体化信息技术在临床研究中的应用
Application of Integrated Information Technology in Clinical Research
佟刚
三生制药集团研发中心
TONG Gang
R&D Center of 3S Bio Group
赵守柱*
北京百奥知信息科技有限公司
ZHAO Shou-zhu*
Beijing Bioknow Info. Tech. Co., Ltd.
庄永龙
北京百奥知信息科技有限公司
ZHUANG Yong-long
Beijing Bioknow Info. Tech. Co., Ltd.
颜崇超*
江苏恒瑞医药股份有限公司
YAN Chong-chao*
Jiangsu Hengri Pharmaceuticals Co., Ltd.
摘 要 Abstract
利用信息化技术提高临床研发的效率与质量已经成为制药企业发展的必然趋势。临床研究信息化系统因监管要求严格、使用人员众多、临床研究工作分工细、工作流复杂等特点,同一个临床研究项目需要使用不同的信息化系统,各系统因缺乏信息交互,常造成信息孤岛, 增加了许多重复工作,严重地影响了数据的使用效率,也不利于大数据的信息挖掘。本文以符合监管机构要求、满足临床研究业务需求为前提,探讨临床研究一体化技术建设在制药企业的实践,以期提升临床研发效率。
Using information technology to improve the efficiency and quality of clinical research has become an inevitable trend in the development of pharmaceutical enterprises. Clinical research information system is characterized by strict regulatory requirements, numerous users, fine division of clinical research tasks and complex workflow. Different information systems are, therefore, required in a single clinical trial. The lack of information sharing among different systems often results in isolated information island and repetition of work, which seriously affect the efficiency of data use and are not conducive to information mining with big data. This paper discusses the practice of technology integration in clinical research settings by pharmaceutical enterprises that meets regulatory requirements and satisfies clinical research needs, with a view to improving the efficiency of clinical R&D.
药物研发因风险高、周期长、参与人员多、工作内容复杂等特点,迫切地需要信息化技术的支持。跨国制药企业的信息化系统已经应用于临床研究的几乎所有领域,如临床试验项目管理系统(clinicaltrial management system,CTMS)、基于风险的监查(riskbased monitoring,RBM)、药物警戒(pharmacovigilance,PV)、电子试验主文档(electronic trialmaster file,eTMF)及电子通用技术文档(electronic commontechnical document,eCTD)等。以临床数据的信息化为例,除电子数据采集系统(electronicdata capture,EDC) 外, 临床研究还广泛使用随机化与药品管理系统(randomizationand trial supply management,RTSM)、电子化患者报告结局(electronic patient-reportedoutcome,ePRO)、医学编码系统(MedCoding)、外部数据管理系统(external datamanagement,EDM) 以及临床数据全流程管理系统(clinical data total management system,CDTMS)等[1-3]。图1表示临床研究信息化系统之间的多重关联。可见,从业务流程上来看,各个系统之间并非是孤立的,而是存在着密切的关系。其中,EDC 作为临床研究数据采集的核心系统,与CTMS、eTMF、ePRO、RTSM、MedCoding、PV、CDTMS 等多个系统存在关联。除此之外, 其他系统两两之间也存在着关联,如CTMS与eTMF、PV 与eTMF、PV 与MedCoding、CTMS与RTSM等。
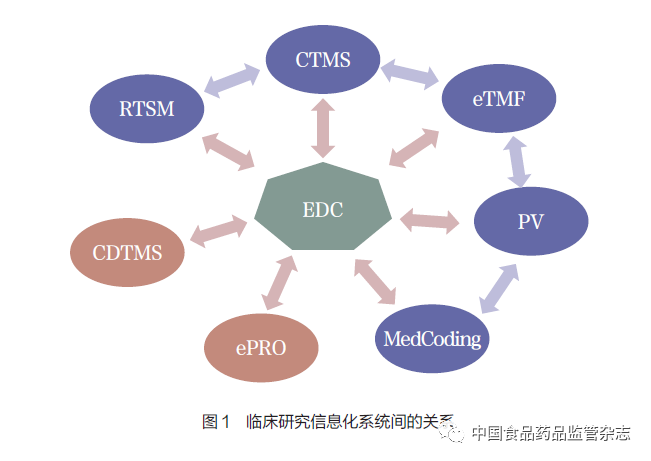
跨国制药企业一直在追求信息技术的一体化并付出了不少努力,但是由于种种原因一体化始终没有得到很好地实现,导致各系统间缺乏高效的互联互通,数据整合采用更多的是系统外的手工操作或者是建立更大的数据仓库。
国内制药企业的临床研究信息化普及程度低于跨国制药企业, 主要是因为我国临床研究起步较晚,基本还处于纸质与手工阶段, 如临床监查员(clinical research associate,CRA)与项目经理(project manager,PM)需要花费大量时间手工整理各项目的进展,如入组汇总、严重不良事件汇总、 方案违背汇总以及eTMF 汇总等。因此, 数据的准确性、及时性以及可追溯性等均难以保证,再加上文件的本地化管理,缺乏版本控制,员工离职等因素也常导致资料缺失。这些均严重地制约了国内制药企业的高质量发展, 特别是国际化发展的需要[3]。
随着国家对科技创新的大力支持,监管机构也出台了一系列的规范与指南,国内制药企业在药物研发方面的投入力度不断增加,临床研究信息化水平也得到了普遍的提升。在此基础上,制药企业将关注的重点从单一的系统转向临床研究的一体化,以实现临床研究效率与质量的提升,并实现我国企业信息化水平的弯道超车[1,4]。
一、临床研发信息化建设的必要性
国内制药企业对于信息化的要求主要是基于监管机构的规范化要求、信息化技术的进步,以及企业自身发展的业务需要。
近年来,国家将创新药作为国家战略,对新药创制给予了高度重视。特别是在加入国际人用药品注册技术协调会(ICH)后,国家倡导使用国际成熟的技术标准与规范,并从药品研发的各个角度,发布了一系列的指导原则与要求,促进了行业的规范化发展,主要表现在2016 年的数据管理技术规范、电子数据采集技术指导原则[5],2018 年的药品安全报告管理的主体责任人制度[6]、电子CTD 格式提交的技术要求[7]以及2020 年的真实世界证据支持药物研发的基本考虑[8] 等,从多个方面对药物研发提出更高的要求。特别是2020 年7 月1 日起施行的《药品注册管理办法》[9]和《药物临床试验质量管理规范》[10],均对临床研究及其信息化技术提出了更高的要求。
从药物研发角度特别是从临床研发的角度来看,临床试验涉及申办方、研究机构,伦理委员会、研究者、现场管理组织(site management organization,SMO)、 合同研究组织(contract research organization ,CRO)、检测单位等方方面面。临床试验过程需要采集各种不同类型的数据,如体格检查、疾病评估、中心实验室数据、肿瘤影像学数据等,并会产生多个文件,如知情同意书、药品发放与接收文件、EDC 测试报告、监查计划与报告、数据管理计划与报告等。这些数据与文件来自受试者、研究者、中心实验室、影像学等单位与个人,文件记录与版本控制也需要有良好的管理规范[11]。
从行业来看,目前临床研究人才相对短缺,人才流动性高也使得项目管理急需要信息化系统。
此外,当前信息化技术的发展与进步,包括云平台、5G 技术以及移动技术等的应用,也为制药企业的信息化发展提供了必要的基础[12]。
二、信息化建设面临的挑战
(一)跨国企业信息化建设面临的挑战
相对于国内项目总体来说,国外项目的信息化系统使用程度高,应用范围广,信息化系统功能与规范均能满足业务的需要,但就系统与系统间整合的一体化而言,国外系统间的整合存在一定的难度,主要有以下几个原因。
第一,国外系统经历过多年的探索与发展成为成熟的专业化软件,以满足特定临床研究某一特殊的业务需求,如CTMS 主要用于项目的计划、进度、人员、费用、监查等的管理,EDC主要用于数据的采集与清理,MedCoding 主要用于临床数据的MedDRA 编码与WHODrug编码,PV 主要用于安全数据的采集、报告、数据挖掘与风险评估,eTMF 主要是管理临床研究主文档,eCTD 主要用于专业化注册申报文档的组织与提交。各系统的专业化程度高,但其可扩展性相对较差。
第二,在制药企业中各系统的用户一般都是独立的部门,如EDC 主要使用者是数据管理部门,而PV 主要使用者是药物安全管理部门。由于系统分属不同的部门,各系统均需要独立的信息管理人员,如数据库管理员、软件与硬件维护人员、技术支持人员。他们隶属于不同部门,一般也不探讨深度的数据交换与共享。
第三,各系统间数据的交换与共享常受到各种技术与人为因素的制约,如各系统之间的数据结构、数据库类型、数据交换的接口以及开发商的支持力度等。有的企业在推进系统整合的过程中,遇到了各系统使用的历史、新系统人员培训、用户的可接受度等诸多方面的挑战,更不要说前期新系统的投入成本。特别是新数据与历史数据的整合,也面临诸多难题,需要花费额外的人力、物力与时间进行系统外的数据整合。
近年来,很多公司开始涉及其他系统的开发,主要的原因除了临床研究系统的互通性(如同一个临床研究项目的不同业务部门使用,且具有相同的规范性要求)之外,还有一部分原因是便于实现系统间数据的有效对接,从而消除因不同供应商之间的数据整合带来的种种困扰。
(二)国内企业信息化建设面临的挑战
提高国内企业信息化水平,经常会遇到各种各样的挑战,主要包括以下几个方面。
第一,管理层的重视程度与投入力度,包括人力与财力。临床研究信息化的实施不是简单的系统安装与维护,更重要的是涉及系统的业务需求与业务流程的整合与变更。
第二,信息化系统的选择。目前商业化软件很多,选择一款适合本公司需求的系统需要考虑多种因素,除了系统开发商的质量管理体系、软件的性能与可靠性、系统的成熟度与稳定性以及用户的体验感外, 还需要考虑系统使用者的学习成本、系统支持的效率等。更为重要的是,系统开发商是否有足够的能力去开发基于一体化的、可实现临床研究信息的互联互通的电子化系统。
第三,新修订《药物临床试验质量管理规范》第三十六条明确要求[10],系统在使用前需要进行验证, 与系统相关业务的开展需要有与之相对应的标准操作规程( standard operation process,SOP)来支持。系统上线后,需要在系统全生命周期内持续维护系统的已验证状态。
第四,使用云平台。云平台技术可以节省机房维护、服务器购买、更新以及运维人员等费用,其安全性也得到了充分的保证。在很大程度上,云平台使得系统的部署与使用更便捷、更灵活、更高效、更经济,也更安全。近年来,云平台受到用户的普遍欢迎,在跨国企业中得到了广泛使用。但是,由于各种原因,国内云平台接受度相对较低,云平台的使用与落实与跨国企业还有一定的距离。
第五,目前国内企业主要关注单一系统的使用,以满足某个特定的功能场景需要,完成临床研究的相关工作。在数据采集及管理方面,EDC 已经广为业界认可,其优势也不断被项目用户所接受。2020 年的调查表明,国内项目EDC 的使用率已经高于80%。特别在此次疫情期间,电子化与远程学习技术得到了广泛的应用,并发挥出越来越大的优势[13]。但是,目前很少有公司关注系统的一体化建设,也很少关注临床数据间的互联互通。
国内制药企业的信息化起步相对较晚,可以在顶层设计阶段,使用符合国情的一体化信息解决方案,利用有限的资金与成本,实现各系统间数据的整合与互联互通,提高临床研发的效率与质量。
(三)信息技术自身的挑战
临床研究系统的一体化也面临来自信息技术自身的挑战,前面提到同一个项目会使用不同的信息化系统( 图1)。比如, 同一个项目, 数据采集需要使用EDC,药物的随机化需要使用RTSM,临床试验数据编码需要使用MedCoding。不同角色的用户也会需要使用CTMS,eTMF、ePRO、PV 等系统(表1)
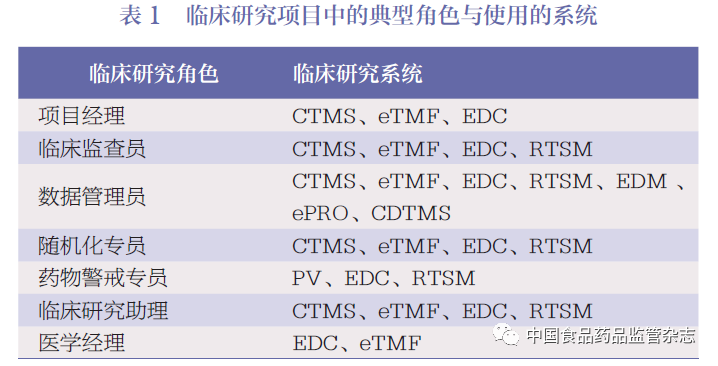
如果各系统独立运行、系统间缺乏互联互通, 项目组人员需要登录不同的子系统, 如项目经理会使用CTMS、eTMF、EDC。如果这些系统来自不同的供应商,且使用不同的用户名与密码,每个用户又同时负责多个项目,每个项目又分别使用不同的EDC、不同的CTMS、不同的PV(这种情形常见于CRO,有时也见于申办方),那么,账户管理、系统登录网址管理等将会变得更为复杂,也会给用户的使用与技术支持带来很大的困难[1-2]。
更为重要的是,项目名称与项目代码、研究中心与研究者等项目公用信息,由于系统间缺乏互联互通,这些信息需要在不同系统中重复录入,为了防止录入错误,还需要进行一致性比对检查,增加了项目组的工作量与工作时间,严重影响工作的效率与质量。
三、临床研究一体化平台的实施方案与法规考量
(一)临床研究一体化平台的实施方案