
随着中国临床试验所处的政策环境和行业环境不断成熟,文档管理所要求的的数据真实完整准确越来越成为关注重点。文档管理主要包括文件的设计、制定、修订、审核、批准、撤销、复制、发放、回收、培训、执行、保管和销毁等一系列过程的管理活动。无论是创新药物还是一致性评价的仿制药物,临床试验过程中产生的高质量合规试验文档(TMF)可用来证明临床试验的真实性、准确性和可靠性,是临床试验期间和结束之后再现临床试验的全过程和对有关试验作出主要决策与流程监督结果的依据。CFDA遵循国际通用数据质量原则ALCOA+,亦对临床试验数据链证据提出了完整性和可溯源性等基本要求。在临床试验数据结果的自查核查中,试验主文档的检查已成为不可或缺的重要内容之一。
DIA文档管理培训期间,国内知名专家为您带来ICH-GCP对临床试验主文档的定义和监管要求、TMF的监管环境、中国GCP对文档管理规范的要求、全球TMF参考模式、TMF系统构建与验证要求,通过案例解析临床试验中常见管理性文件的类别、内容要点、应用和监管要求。

百奥知,作为我国第一个具有自主知识产权的生命科学信息云平台,倾情支持DIA本次文档管理培训,并作为赞助商分享为生命科学行业倾力打造的eTMF解决解决方案,帮助临床试验申办方、CRO和研究基地将文档管理统一汇聚于云平台。
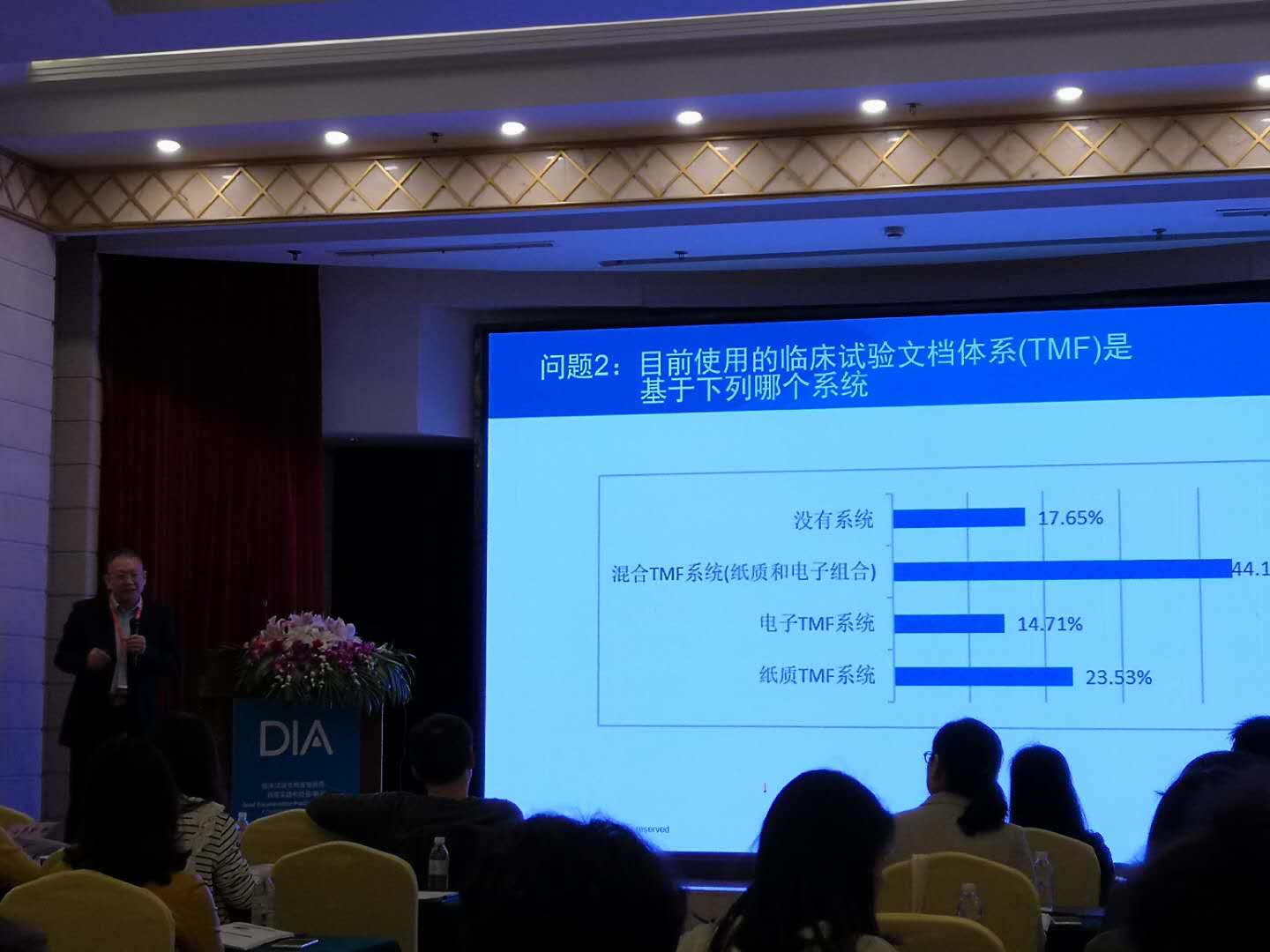
百奥知项目总监赵守柱,作为具备多年行业和项目运作经验的从业人员,于2018年4月13日的会议中,向参会人员介绍了目前我国临床试验文档管理的现状,指出存在标准不统一、计划不明确、管理效率低等问题,分享了百奥知为生命科学行业全新打造的TMF解决方案——Bioknow eTMF,具有流程化管理,快速创建计划、实时提醒、及时上传、规范管理、整体把控。能完美地帮助临床试验申办方、CRO和研究基地将文档管理统一汇聚于云平台。